Ш§Щ„Щ…ЩӮШҜЩ…Ш©
Ш§Щ„Щ…Ш§ШҜШ© ЩҒЩҠ Ш§Щ„ЩҲШіШ· Ш§Щ„Щ…ШӯЩҠШ·
Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Ш§Щ„ЩҶЩӮЩҠШ© ЩҒЩҠ Ш§Щ„ЩҲШіШ· Ш§Щ„Щ…ШӯЩҠШ·
Ш§Щ„Ш°ШұШ§ШӘ ЩҲШ§Щ„Ш¬ШІЩҠШҰШ§ШӘ
ШЁЩҶЩҠШ© Ш§Щ„Ш°ШұШ©
Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ ЩҲШ§Щ„ШӘЩҲШ§ШІЩҶ
Ш§Щ„Ш§ШіШі ЩҲ Ш§Щ„Ш§ШӯЩ…Ш§Ш¶
Ш§Щ„Щ…Ш№Ш§ШҜЩҶ ЩҲШ§Щ„Ш§Щ…Ш№Ш§ШҜЩҶ
Ш§Щ„Щ…Ш№Ш§ШҜЩҶ ЩҲШ§Щ„Ш§Щ…Ш№Ш§ШҜЩҶ 2
Ш§Щ„ЩғШұШЁЩҲЩҶ ЩҲЩ…ШұЩғШЁШ§ШӘЩҮ
Ш§Щ„Ш¬ШҜЩҲЩ„ Ш§Щ„ШҜЩҲШұЩҠ Щ„Щ„Ш№ЩҶШ§ШөШұ
Ш§Щ„Ш§Щ„ЩҠШ§ЩҒ Ш§Щ„ШөЩҶШ§Ш№ЩҠШ© ЩҲШ§Щ„ШЁЩ„Ш§ШіШӘЩҠЩғ
Ш§Щ„ЩҒШӯЩ… ЩҲШ§Щ„ШЁШӘШұЩҲЩ„
Ш§Щ„Ш§ШӯШӘШұШ§ЩӮ ЩҲШ§Щ„Щ„ЩҮШЁ
ШӘЩҸШ№ШұЩҒ Ш§Щ„Ш№Щ…Щ„ЩҠШ© Ш§Щ„ШӘЩҠ ШӘШӘЩҒШ§Ш№Щ„ ЩҒЩҠЩҮШ§ Щ…Ш§ШҜШ© ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ЩҲШ§ШӯШҜШ© ШЈЩҲ ШЈЩғШ«Шұ Щ…Ш№ Щ…Ш§ШҜШ© ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ШЈШ®ШұЩү ЩҲШӘШӘШӯЩҲЩ„ ШҘЩ„Щү Щ…Ш§ШҜШ© Щ…Ш®ШӘЩ„ЩҒШ© ШЈЩҲ ШЈЩғШ«Шұ ШЁШ§ШіЩ… Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ.
Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ©
Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ЩҮЩҠ Ш№ШұШ¶ ШұЩ…ШІЩҠ Щ„ШӘЩҒШ§Ш№Щ„ ЩғЩҠЩ…ЩҠШ§ШҰЩҠ Шӣ ЩҠШӘЩ… ШӘЩ…Ш«ЩҠЩ„ЩҮ Щ…ЩҶ Ш®Щ„Ш§Щ„ Ш§Щ„ШұЩ…ЩҲШІ ЩҲШ§Щ„ШөЩҠШә. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„
Ш§Щ„Щ…ШәЩҶЩҠШіЩҠЩҲЩ… + Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ = ШЈЩғШіЩҠШҜ Ш§Щ„Щ…ШәЩҶЩҠШіЩҠЩҲЩ…
Mg + O2 = MgO
ШӘЩҸШ№ШұЩҒ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШәЩҶЩҠШіЩҠЩҲЩ… ЩҲШ§Щ„ШЈЩғШіШ¬ЩҠЩҶ ШЁШ§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш© ЩҲ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„ЩҶШ§ШӘШ¬Ш© Ш№ЩҶ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҢ ЩҠЩҸШ№ШұЩҒ ШЈЩғШіЩҠШҜ Ш§Щ„Щ…ШәЩҶЩҠШіЩҠЩҲЩ… ШЁШ§Щ„Щ…Ш§ШҜШ© Ш§Щ„ЩҶШ§ШӘШ¬Ш©.
ШӘШ°ЩғШұ ШЈЩҶ Ш§Щ„ЩғШӘЩ„Ш© Ш§Щ„ЩғЩ„ЩҠШ© Щ„Щ„Ш№ЩҶШ§ШөШұ Ш§Щ„Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ ЩҶЩҲШ§ШӘШ¬ ШӘЩҒШ§Ш№Щ„ ЩғЩҠЩ…ЩҠШ§ШҰЩҠ ЩҠШ¬ШЁ ШЈЩҶ ШӘЩғЩҲЩҶ Щ…ШіШ§ЩҲЩҠШ© Щ„Щ„ЩғШӘЩ„Ш© Ш§Щ„ЩғЩ„ЩҠШ© Щ„Щ„Ш№ЩҶШ§ШөШұ Ш§Щ„Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш©.
ЩҠШёЩ„ Ш№ШҜШҜ Ш°ШұШ§ШӘ ЩғЩ„ Ш№ЩҶШөШұ Ш«Ш§ШЁШӘЩӢШ§ ШҜШ§ШҰЩ…ЩӢШ§ ЩӮШЁЩ„ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ ЩҲШЁШ№ШҜЩҮ.
ШЈЩҶЩҲШ§Ш№ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ
ЩҒЩҠЩ…Ш§ ЩҠЩ„ЩҠ Ш§Щ„ШЈЩҶЩҲШ§Ш№ Ш§Щ„ШұШҰЩҠШіЩҠШ© Щ„Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ :
1. ШӘЩҒШ§Ш№Щ„ ШӘШұЩғЩҠШЁЩҠ (Ш§Щ„Щ…ШЁШ§ШҙШұ)
2. Ш§Щ„ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ (ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ШӘЩҒШ§Ш№Щ„)
3. Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШӘШҙШұШҜ
ШҜШ№ЩҲЩҶШ§ ЩҶЩҶШ§ЩӮШҙ ЩғЩ„ Щ…ЩҶЩҮЩ… ШЁШҘЩҠШ¬Ш§ШІ
1. ШӘЩҒШ§Ш№Щ„ ШӘШұЩғЩҠШЁЩҠ (Ш§Щ„Щ…ШЁШ§ШҙШұ)
Ш№ЩҶШҜЩ…Ш§ ШӘШӘЩҒШ§Ш№Щ„ Щ…Ш§ШҜШӘШ§ЩҶ ШЈЩҲ ШЈЩғШ«Шұ (ШЈЩҠ Ш№ЩҶШ§ШөШұ ШЈЩҲ Щ…ШұЩғШЁШ§ШӘ) Щ„ШӘШҙЩғЩҠЩ„ Щ…ЩҶШӘШ¬ ЩҲШ§ШӯШҜ ШҢ ЩҠЩҸШ№ШұЩҒ ЩҮШ°Ш§ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШЁШ§ШіЩ… Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШұЩғШЁ (Ш§Щ„Щ…ШЁШ§ШҙШұ). Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„
CaO(s) +H2O(1)→Ca(OH)2(aq)
(ШЈЩғШіЩҠШҜ Ш§Щ„ЩғШ§Щ„ШіЩҠЩҲЩ…) (ЩҮЩҠШҜШұЩҲЩғШіЩҠШҜ Ш§Щ„ЩғШ§Щ„ШіЩҠЩҲЩ…)
ЩғЩ…Ш§ ЩҮЩҲ Щ…ЩҲШ¶Шӯ ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШЈШ№Щ„Ш§ЩҮ ШҢ ШӘЩҒШ§Ш№Щ„ ШЈЩғШіЩҠШҜ Ш§Щ„ЩғШ§Щ„ШіЩҠЩҲЩ… ЩҲШ§Щ„Щ…Ш§ШЎ (ШЈЩҲ Щ…Ш¬ШӘЩ…Ш№ЩҠЩҶ) Щ„ШӘЩғЩҲЩҠЩҶ Щ…ЩҶШӘШ¬ ЩҲШ§ШӯШҜ ШҢ ЩҠЩҸШ№ШұЩҒ ШЁШ§ШіЩ… ЩҮЩҠШҜШұЩҲЩғШіЩҠШҜ Ш§Щ„ЩғШ§Щ„ШіЩҠЩҲЩ….
ЩҠЩҸШ№ШұЩҒ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ Ш§Щ„Ш°ЩҠ ЩҠШӘЩ… ЩҒЩҠЩҮ ШҘШ·Щ„Ш§ЩӮ ШӯШұШ§ШұШ© ШЈШ«ЩҶШ§ШЎ ШӘЩғЩҲЩҠЩҶ Ш§Щ„Щ…ЩҶШӘШ¬ ШЁШ§ШіЩ… Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Ш§Щ„Ш·Ш§ШұШҜШ© Щ„Щ„ШӯШұШ§ШұШ©.
2. Ш§Щ„ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ (ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ШӘЩҒШ§Ш№Щ„)
ЩҠЩҸШ№ШұЩҒ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҢ Ш§Щ„Ш°ЩҠ ШӘШӘЩҒЩғЩғ ЩҒЩҠЩҮ Ш§Щ„Щ…Ш§ШҜШ© Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш© ШҘЩ„Щү Щ…ЩҶШӘШ¬Ш§ШӘ ШЈШЁШіШ· ШҢ ШЁШ§ШіЩ… Ш§Щ„ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠ (ШӘШӯЩ„ЩҠЩ„ Ш§Щ„ШӘЩҒШ§Ш№Щ„)

Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„
ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…Ш°ЩғЩҲШұ ШЈШ№Щ„Ш§ЩҮ ШҢ ШЁЩ„ЩҲШұШ§ШӘ ЩғШЁШұЩҠШӘШ§ШӘ Ш§Щ„ШӯШҜЩҠШҜ (ШЈЩҠ FeSO4 ШҢ 7H2O) ШҢ Ш№ЩҶШҜ ШӘШіШ®ЩҠЩҶЩҮШ§ ШҢ ШӘЩҒЩӮШҜ Ш§Щ„Щ…Ш§ШЎ ЩҲЩҠШӘШәЩҠШұ Щ„ЩҲЩҶ Ш§Щ„ШЁЩ„ЩҲШұШ§ШӘ. ШЈШ®ЩҠШұЩӢШ§ ШҢ ЩҠШӘШӯЩ„Щ„ ШҘЩ„Щү ШЈЩғШіЩҠШҜ Ш§Щ„ШӯШҜЩҠШҜ (Fe2O3) ЩҲШ«Ш§ЩҶЩҠ ШЈЩғШіЩҠШҜ Ш§Щ„ЩғШЁШұЩҠШӘ (SO2) ЩҲШ«Ш§Щ„Ш« ШЈЩғШіЩҠШҜ Ш§Щ„ЩғШЁШұЩҠШӘ (SO3).
3. Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШӘШҙШұШҜ
ЩҠЩҸШ№ШұЩҒ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҢ Ш§Щ„Ш°ЩҠ ЩҠЩӮЩҲЩ… ЩҒЩҠЩҮ Ш№ЩҶШөШұ ШЁШҘШІШ§ШӯШ© Ш№ЩҶШөШұ ШўШ®Шұ ШЈЩҲ ШҘШІШ§Щ„ШӘЩҮ ШҢ ШЁШ§ШіЩ… ШӘЩҒШ§Ш№Щ„ Ш§Щ„ШҘШІШ§ШӯШ© ШЈЩҲ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШӘШҙШұШҜ
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(ЩғШЁШұЩҠШӘШ§ШӘ Ш§Щ„ЩҶШӯШ§Ші) (ЩғШЁШұЩҠШӘШ§ШӘ Ш§Щ„ШӯШҜЩҠШҜ)
Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„
ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…Ш°ЩғЩҲШұ ШЈШ№Щ„Ш§ЩҮ ШҢ ШЈШІШ§Шӯ Ш§Щ„ШӯШҜЩҠШҜ Ш§Щ„ЩҶШӯШ§Ші Щ…ЩҶ Щ…ШӯЩ„ЩҲЩ„ ЩғШЁШұЩҠШӘШ§ШӘ Ш§Щ„ЩҶШӯШ§Ші ЩҲЩҠШҙЩғЩ„ ЩғШЁШұЩҠШӘШ§ШӘ Ш§Щ„ШӯШҜЩҠШҜ.
ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш§Щ„Ш§ЩғШіШҜШ© ЩҲШ§Щ„Ш§ШұШ¬Ш§Ш№
ШҘШ°Ш§ Ш§ЩғШӘШіШЁШӘ Щ…Ш§ШҜШ© Щ…Ш§ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ШЈШ«ЩҶШ§ШЎ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҢ ШӘШіЩ…Щү ЩҮШ°ЩҮ Ш§Щ„Ш№Щ…Щ„ЩҠШ© ШЁШ§Щ„ШЈЩғШіШҜШ©. Щ…ЩҶ ЩҶШ§ШӯЩҠШ© ШЈШ®ШұЩү ШҢ ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҢ ШҘШ°Ш§ ЩҒЩӮШҜШӘ Щ…Ш§ШҜШ© Щ…Ш§ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ШҢ ЩҒШӘШ№ШұЩҒ ЩҮШ°ЩҮ Ш§Щ„Ш№Щ…Щ„ЩҠШ© ШЁШ§Щ„Ш§ШұШ¬Ш§Ш№. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„
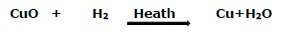
ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…Ш°ЩғЩҲШұ ШЈШ№Щ„Ш§ЩҮ ШҢ ЩҠЩҒЩӮШҜ ШЈЩғШіЩҠШҜ Ш§Щ„ЩҶШӯШ§Ші Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ЩҲШЁШ§Щ„ШӘШ§Щ„ЩҠ ЩҠЩҸШұШ¬Ш№ (ШЈЩҠ Ш§Щ„Ш§ШұШ¬Ш§Ш№) Шӣ Щ…ЩҶ ЩҶШ§ШӯЩҠШ© ШЈШ®ШұЩү ШҢ ЩҠЩғШӘШіШЁ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ЩҲШЁШ§Щ„ШӘШ§Щ„ЩҠ ЩҠШӘШЈЩғШіШҜ (ШЈЩҠ Ш§Щ„ШЈЩғШіШҜШ©).
Ш§Щ„ШӘШўЩғЩ„
Ш№ЩҶШҜЩ…Ш§ ЩҠШӘЩ… Щ…ЩҮШ§Ш¬Щ…Ш© Ш§Щ„Щ…Ш№ШҜЩҶ ШЁЩ…ЩҲШ§ШҜ Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ Ш§Щ„ШЁЩҠШҰШ© Ш§Щ„Щ…ШЁШ§ШҙШұШ© ШҢ Щ…Ш«Щ„ Ш§Щ„ШұШ·ЩҲШЁШ© ЩҲШ§Щ„ШЈШӯЩ…Ш§Ш¶ ЩҲЩ…Ш§ ШҘЩ„Щү Ш°Щ„Щғ ШҢ ЩҠЩҸШ№ШұЩҒ Ш°Щ„Щғ ШЁШ§Щ„ШӘШўЩғЩ„. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„ Ш§Щ„Ш·Щ„Ш§ШЎ Ш§Щ„ШЈШіЩҲШҜ Ш№Щ„Щү Ш§Щ„ЩҒШ¶Ш© ШҢ ЩҲШ§Щ„Ш·Щ„Ш§ШЎ Ш§Щ„ШЈШ®Ш¶Шұ Ш№Щ„Щү Ш§Щ„ЩҶШӯШ§Ші ШҢ ЩҲЩ…Ш§ ШҘЩ„Щү Ш°Щ„Щғ

Ш№Щ…Щ„ЩҠШ© Ш§Щ„ШӘШІЩҶШ®
Ш№ЩҶШҜЩ…Ш§ ШӘШӘШЈЩғШіШҜ Ш§Щ„ШҜЩҮЩҲЩҶ ЩҲШ§Щ„ШІЩҠЩҲШӘ ШҢ ШӘЩҸШ№ШұЩҒ Ш§Щ„Ш№Щ…Щ„ЩҠШ© ШЁШ§ШіЩ… Ш§Щ„ШӘШІЩҶШ®. ЩғЩ…Ш§ ШӘШӘШәЩҠШұ ШұШ§ШҰШӯШӘЩҮШ§ ЩҲШ·Ш№Щ…ЩҮШ§ ЩҲЩ„ЩҲЩҶЩҮШ§ ЩҲЩ…Ш§ ШҘЩ„Щү Ш°Щ„Щғ Шӣ ЩҲШЁШ§Щ„Щ…Ш«Щ„ ШҢ Ш¬Ш№Щ„ Ш§Щ„Ш·Ш№Ш§Щ… ШәЩҠШұ ШўЩ…ЩҶ Щ„Щ„Ш§ШіШӘЩҮЩ„Ш§Щғ.
Щ„Ш§ ЩҠЩҲШ¬ШҜ ШӘШ№Щ„ЩҠЩӮШ§ШӘ
Щ„Ш§Ш¶Ш§ЩҒШ© ШіШӨШ§Щ„ Ш§ЩҲ ШӘШ№Щ„ЩҠЩӮ Ш№Щ„Щү Ш§Щ„ШҜШұШі ЩҠШӘЩҲШ¬ШЁ Ш№Щ„ЩҠЩғ ШӘШіШ¬ЩҠЩ„ Ш§Щ„ШҜШ®ЩҲЩ„
ШӘШіШ¬ЩҠЩ„ Ш§Щ„ШҜШ®ЩҲЩ„