Ш§Щ„Щ…ЩӮШҜЩ…Ш©
Ш§Щ„Щ…Ш§ШҜШ© ЩҒЩҠ Ш§Щ„ЩҲШіШ· Ш§Щ„Щ…ШӯЩҠШ·
Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Ш§Щ„ЩҶЩӮЩҠШ© ЩҒЩҠ Ш§Щ„ЩҲШіШ· Ш§Щ„Щ…ШӯЩҠШ·
Ш§Щ„Ш°ШұШ§ШӘ ЩҲШ§Щ„Ш¬ШІЩҠШҰШ§ШӘ
ШЁЩҶЩҠШ© Ш§Щ„Ш°ШұШ©
Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ ЩҲШ§Щ„ШӘЩҲШ§ШІЩҶ
Ш§Щ„Ш§ШіШі ЩҲ Ш§Щ„Ш§ШӯЩ…Ш§Ш¶
Ш§Щ„Щ…Ш№Ш§ШҜЩҶ ЩҲШ§Щ„Ш§Щ…Ш№Ш§ШҜЩҶ
Ш§Щ„Щ…Ш№Ш§ШҜЩҶ ЩҲШ§Щ„Ш§Щ…Ш№Ш§ШҜЩҶ 2
Ш§Щ„ЩғШұШЁЩҲЩҶ ЩҲЩ…ШұЩғШЁШ§ШӘЩҮ
Ш§Щ„Ш¬ШҜЩҲЩ„ Ш§Щ„ШҜЩҲШұЩҠ Щ„Щ„Ш№ЩҶШ§ШөШұ
Ш§Щ„Ш§Щ„ЩҠШ§ЩҒ Ш§Щ„ШөЩҶШ§Ш№ЩҠШ© ЩҲШ§Щ„ШЁЩ„Ш§ШіШӘЩҠЩғ
Ш§Щ„ЩҒШӯЩ… ЩҲШ§Щ„ШЁШӘШұЩҲЩ„
Ш§Щ„Ш§ШӯШӘШұШ§ЩӮ ЩҲШ§Щ„Щ„ЩҮШЁ
ШЁШӯЩ„ЩҲЩ„ Ш№Ш§Щ… 1900 ШҢ ШӘЩ… Ш§ЩғШӘШҙШ§ЩҒ ШЈЩҶ Ш§Щ„Ш°ШұШ© Щ„Щ… ШӘЩғЩҶ Ш¬ШіЩҠЩ…ЩӢШ§ ШЁШіЩҠШ·ЩӢШ§ ШәЩҠШұ ЩӮШ§ШЁЩ„ Щ„Щ„ШӘШ¬ШІШҰШ© ШҢ ЩҲЩ„ЩғЩҶЩҮШ§ ШӘШӯШӘЩҲЩҠ Ш№Щ„Щү Ш¬ШіЩҠЩ…Ш§ШӘ ШҙШЁЩҮ Ш°ШұЩҠШ©.
Ш§ЩғШӘШҙЩҒ Ш·ЩҲЩ…ШіЩҲЩҶ (J.J. Thomson) Ш§Щ„Ш¬ШіЩҠЩ…Ш§ШӘ Ш§Щ„ШҙШЁЩҮ Ш°ШұЩҠШ© ЩҲЩҮЩҠ "Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶ".

ЩғШ§ЩҶ Ш·ЩҲЩ…ШіЩҲЩҶ ШЈЩҲЩ„ ШҙШ®Шө Ш§ЩӮШӘШұШӯ ЩҶЩ…ЩҲШ°Ш¬ЩӢШ§ Щ„ШЁЩҶЩҠШ© Ш§Щ„Ш°ШұШ©.
ЩҒЩҠ Ш№Ш§Щ… 1886 ШҢ Ш§ЩғШӘШҙЩҒ ШҘ. ШәЩҲЩ„ШҜШҙШӘШ§ЩҠЩҶ ЩҲШ¬ЩҲШҜ ШҘШҙШ№Ш§Ш№Ш§ШӘ Ш¬ШҜЩҠШҜШ© ЩҒЩҠ ШӘЩҒШұЩҠШә Ш§Щ„ШәШ§ШІ ЩҲШЈШ·Щ„ЩӮ Ш№Щ„ЩҠЩҮШ§ Ш§ШіЩ… ШЈШҙШ№Ш© Ш§Щ„ЩӮЩҶШ§Ш© canal rays.
ШӘЩ… Ш§ЩғШӘШҙШ§ЩҒ Ш¬ШіЩҠЩ… ШҙШЁЩҮ Ш°ШұЩҠ Щ…ЩҲШ¬ШЁ Ш§Щ„ШҙШӯЩҶШ© ШЁШӘШ¬Ш§ШұШЁ ШЈШҙШ№Ш© Ш§Щ„ЩӮЩҶШ§Ш© ЩҲШЈШ·Щ„ЩӮ Ш№Щ„ЩҠЩҮ Ш§ШіЩ… Ш§Щ„ШЁШұЩҲШӘЩҲЩҶ.
ЩҶЩ…ЩҲШ°Ш¬ Ш°ШұШ© Ш·ЩҲЩ…ШіЩҲЩҶ
Ш§ЩӮШӘШұШӯ Ш·ЩҲЩ…ШіЩҲЩҶ ШЈЩҶ Ш§Щ„Ш°ШұШ© ШӘШӘЩғЩҲЩҶ Щ…ЩҶ ЩғШұШ© Щ…ЩҲШ¬ШЁШ© Ш§Щ„ШҙШӯЩҶШ© ЩҲШЈЩҶ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ (Ш§Щ„ШҙШӯЩҶШ© Ш§Щ„ШіШ§Щ„ШЁШ©) Щ…ШӯШӘЩҲШ§ЩҮ ЩҒЩҠЩҮШ§(ЩғЩ…Ш§ ЩҮЩҲ Щ…ЩҲШ¶Шӯ ЩҒЩҠ Ш§Щ„ШөЩҲШұШ© ШЈШҜЩҶШ§ЩҮ).
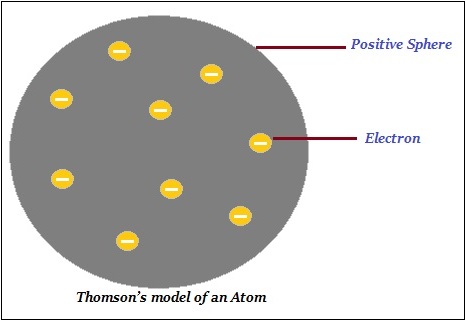
Ш№Щ„Ш§ЩҲШ© Ш№Щ„Щү Ш°Щ„Щғ ШҢ ЩӮШ§Щ„ Ш·ЩҲЩ…ШіЩҲЩҶ ШЈЩҶ Ш§Щ„ШҙШӯЩҶШ§ШӘ Ш§Щ„ШіШ§Щ„ШЁШ© ЩҲШ§Щ„Щ…ЩҲШ¬ШЁШ© Щ…ШӘШіШ§ЩҲЩҠШ© ЩҒЩҠ Ш§Щ„ШӯШ¬Щ…. ЩҲШЁШ§Щ„ШӘШ§Щ„ЩҠ ШҢ ЩҒШҘЩҶ Ш§Щ„Ш°ШұШ© ЩғЩғЩ„ Щ…ШӘШ№Ш§ШҜЩ„Ш© ЩғЩҮШұШЁШ§ШҰЩҠЩӢШ§.
ЩҶЩ…ЩҲШ°Ш¬ Ш°ШұШ© ШұШ°ШұЩҒЩҲШұШҜ
ШұШ°ШұЩҒЩҲШұШҜ Щ…Ш№ШұЩҲЩҒ ШЁШЈЩҶЩҮ "ШЈШЁ" Ш§Щ„ЩҒЩҠШІЩҠШ§ШЎ Ш§Щ„ЩҶЩҲЩҲЩҠШ©.

Ш§ШҙШӘЩҮШұ ШұШ°ШұЩҒЩҲШұШҜ ШҘЩ„Щү ШӯШҜ ЩғШЁЩҠШұ ШЁШ№Щ…Щ„ЩҮ ЩҒЩҠ Ш§Щ„ЩҶШҙШ§Ш· Ш§Щ„ШҘШҙШ№Ш§Ш№ЩҠ ЩҲШ§ЩғШӘШҙШ§ЩҒ ЩҶЩҲШ§Ш© Ш°ШұШ© ШЁШ§ШіШӘШ®ШҜШ§Щ… ШӘШ¬ШұШЁШ© ШұЩӮШ§ШҰЩӮ Ш§Щ„Ш°ЩҮШЁ (ЩғЩ…Ш§ ЩҮЩҲ Щ…ЩҲШ¶Шӯ ЩҒЩҠ Ш§Щ„ШөЩҲШұШ© ШЈШҜЩҶШ§ЩҮ.
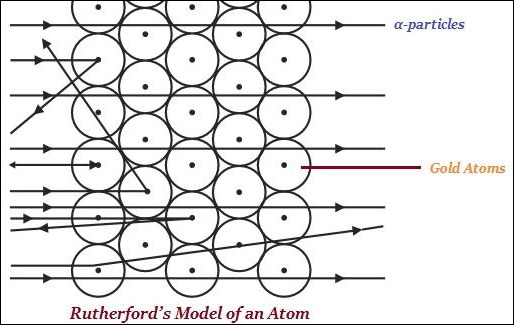
ЩӮШ§Щ„ ШұШ°ШұЩҒЩҲШұШҜ ШЈЩҶЩҮ ЩҒЩҠ Ш§Щ„Ш°ШұШ© ЩҠЩҲШ¬ШҜ Щ…ШұЩғШІ Щ…ЩҲШ¬ШЁ Ш§Щ„ШҙШӯЩҶШ© ЩҠШ№ШұЩҒ ШЁШ§Щ„ЩҶЩҲШ§Ш©.
ЩӮШ§Щ„ ШұШ°ШұЩҒЩҲШұШҜ ШЈЩҶ ЩғЩ„ ЩғШӘЩ„Ш© Ш§Щ„Ш°ШұШ© ШӘЩӮШұЩҠШЁЩӢШ§ Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ Ш§Щ„ЩҶЩҲШ§Ш©.
ЩҲЩҒЩӮЩӢШ§ Щ„ШұЩҲШ°ШұЩҒЩҲШұШҜ ШҢ ШӘШҜЩҲШұ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ШӯЩҲЩ„ Ш§Щ„ЩҶЩҲШ§Ш© ЩҒЩҠ Щ…ШҜШ§ШұШ§ШӘ Щ…ШӯШҜШҜШ© Ш¬ЩҠШҜЩӢШ§.
ЩҶЩ…ЩҲШ°Ш¬ ШЁЩҲЩҮШұ Щ„Щ„Ш°ШұШ©
Щ…ШҜШҜ ЩҶЩҠЩ„ШІ ШЁЩҲШұ ЩҶЩ…ЩҲШ°Ш¬ ШұШ°ШұЩҒЩҲШұШҜ ЩҲШӯШіЩҶ Ш№ЩҠЩҲШЁЩҮ.

ЩҲЩҒЩӮЩӢШ§ Щ„ШЁЩҲЩҮШұ ШҢ ЩҠЩҸШіЩ…Шӯ ЩҒЩӮШ· ШЁЩ…ШҜШ§ШұШ§ШӘ Ш®Ш§ШөШ© Щ…Ш№ЩҠЩҶШ© ШӘЩҸШ№ШұЩҒ ШЁШ§ШіЩ… Щ…ШҜШ§ШұШ§ШӘ Щ…ЩҶЩҒШөЩ„Ш© Щ„Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ШҜШ§Ш®Щ„ Ш§Щ„Ш°ШұШ©.
ЩӮШ§Щ„ ШЁЩҲШұ ШҘЩҶ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Щ„Ш§ ШӘШҙШ№ Ш·Ш§ЩӮШ© ШЈШ«ЩҶШ§ШЎ Ш§Щ„ШҜЩҲШұШ§ЩҶ ЩҒЩҠ Щ…ШҜШ§ШұШ§ШӘ Щ…ЩҶЩҒШөЩ„Ш©.
ШіЩ…Щү ШЁЩҲЩҮШұ Ш§Щ„Щ…ШҜШ§ШұШ§ШӘ ЩғЩ…ШіШӘЩҲЩҠШ§ШӘ Ш·Ш§ЩӮШ© (ЩғЩ…Ш§ ЩҮЩҲ Щ…ЩҲШ¶Шӯ ЩҒЩҠ Ш§Щ„ШөЩҲШұШ© ШЈШҜЩҶШ§ЩҮ).
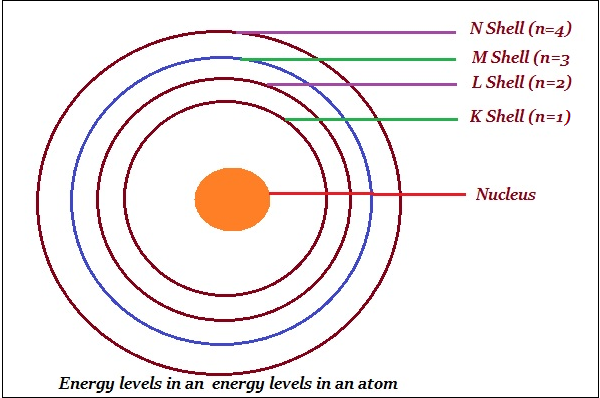
ЩҠЩ…Ш«Щ„ ШЁЩҲЩҮШұ ЩҮШ°ЩҮ Ш§Щ„Щ…ШҜШ§ШұШ§ШӘ ШЁШ§Щ„ШЈШӯШұЩҒ K ШҢ L ШҢ M ШҢ N ШҢ ... ШЈЩҲ Ш§Щ„ШЈШұЩӮШ§Щ… ШҢ n = 1ШҢ2ШҢ3ШҢ4 ШҢ….
ЩҶЩҠЩҲШӘШұЩҲЩҶ
ЩҒЩҠ Ш№Ш§Щ… 1932 ШҢ Ш§ЩғШӘШҙЩҒ Ш¬ЩҠЩҮ ШӘШҙШ§ШҜЩҲЩҠЩғ Ш¬ШіЩҠЩ…ЩӢШ§ ШҙШЁЩҮ Ш°ШұЩҠ Ш¬ШҜЩҠШҜ ШҢ ШЈЩҠ ЩҶЩҠЩҲШӘШұЩҲЩҶ.
Ш§Щ„ЩҶЩҠЩҲШӘШұЩҲЩҶ Щ„ЩҠШі Щ„ЩҮ ШҙШӯЩҶШ© ЩҲЩғШӘЩ„ШӘЩҮ ШӘШіШ§ЩҲЩҠ ШӘЩӮШұЩҠШЁШ§ ЩғШӘЩ„Ш© Ш§Щ„ШЁШұЩҲШӘЩҲЩҶ.
ШӘЩҲШ¬ШҜ Ш§Щ„ЩҶЩҠЩҲШӘШұЩҲЩҶШ§ШӘ ЩҒЩҠ ЩҶЩҲШ§Ш© Ш¬Щ…ЩҠШ№ Ш§Щ„Ш°ШұШ§ШӘ ШҢ Щ…Ш§ Ш№ШҜШ§ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ.
ШӘЩҲШІЩҠШ№ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ЩҒЩҠ Щ…ШҜШ§ШұШ§ШӘ Щ…Ш®ШӘЩ„ЩҒШ©
ЩҠШӘЩ… Ш§Щ„ШӯШөЩҲЩ„ Ш№Щ„Щү Ш§Щ„ШӯШҜ Ш§Щ„ШЈЩӮШөЩү Щ„Ш№ШҜШҜ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Ш§Щ„ШӘЩҠ ЩҠЩ…ЩғЩҶ ШЈЩҶ ШӘЩҲШ¬ШҜ ЩҒЩҠ Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„ЩҲШ§ШӯШҜ ШЁЩҲШ§ШіШ·Ш© Ш§Щ„ШөЩҠШәШ© 2n2..
"n" ЩҮЩҲ ШұЩӮЩ… Ш§Щ„Щ…ШҜШ§Шұ ШЈЩҲ Щ…ШӨШҙШұ Щ…ШіШӘЩҲЩү Ш§Щ„Ш·Ш§ЩӮШ© ШҢ ШЈЩҠ 1 ШҢ 2 ШҢ 3 ШҢ….
ЩҲЩҒЩӮЩӢШ§ Щ„Щ„ШөЩҠШәШ© Ш§Щ„Щ…ШӯШҜШҜШ©
Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„ШЈЩҲЩ„ ШҢ ШЈЩҠ K-shell ШіЩҠЩғЩҲЩҶ = 2 × 12 = 2
Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„Ш«Ш§ЩҶЩҠ ШҢ ШЈЩҠ L-shell ШіЩҠЩғЩҲЩҶ = 2 × 22 = 8
Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„Ш«Ш§Щ„Ш« ШҢ ШЈЩҠ M-shell ШіЩҠЩғЩҲЩҶ = 2 × 32 = 18
Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„ШұШ§ШЁШ№ ШҢ ШЈЩҠ N-shell ШіЩҠЩғЩҲЩҶ = 2 × 42 = 32
ЩҲШЁШ§Щ„Щ…Ш«Щ„ ШҢ ЩҒШҘЩҶ Ш§Щ„ШӯШҜ Ш§Щ„ШЈЩӮШөЩү Щ„Ш№ШҜШҜ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Ш§Щ„ШӘЩҠ ЩҠЩ…ЩғЩҶ Ш§ШіШӘЩҠШ№Ш§ШЁЩҮШ§ ЩҒЩҠ Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„Ш®Ш§ШұШ¬ЩҠ ЩҮЩҲ 8.
Щ„Ш§ ШӘЩ…ШӘЩ„ШҰ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ЩҒЩҠ Щ…ШҜШ§Шұ Щ…Ш№ЩҠЩҶ ШҢ Щ…Ш§ Щ„Щ… ЩҠШӘЩ… Щ…Щ„ШЎ Ш§Щ„Щ…ШҜШ§ШұШ§ШӘ Ш§Щ„ШҜШ§Ш®Щ„ЩҠШ© ШЈЩҲЩ„Ш§ЩӢ. ЩҮШ°Ш§ ЩҠШ№ЩҶЩҠ ШЈЩҶ Ш§Щ„Щ…ШҜШ§ШұШ§ШӘ ШӘЩ…ШӘЩ„ШҰ ШЁШ·ШұЩҠЩӮШ© ШӘШҜШұЩҠШ¬ЩҠШ© Шӣ ШЁШҜШЎЩӢШ§ Щ…ЩҶ Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„ШҜШ§Ш®Щ„ЩҠ ШҘЩ„Щү Ш§Щ„Ш®Ш§ШұШ¬ЩҠ.
Ш§Щ„ШӘЩғШ§ЩҒШӨ
ШӘЩҸШ№ШұЩҒ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Ш§Щ„Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„Ш®Ш§ШұШ¬ЩҠ Щ„Щ„Ш°ШұШ© ШЁШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Ш§Щ„ШӘЩғШ§ЩҒШӨ.
ЩҲЩҒЩӮЩӢШ§ Щ„ЩҶЩ…ЩҲШ°Ш¬ Bohr-Bury ШҢ ЩҠЩ…ЩғЩҶ ШЈЩҶ ЩҠШӯШӘЩҲЩҠ Ш§Щ„Щ…ШҜШ§Шұ Ш§Щ„Ш®Ш§ШұШ¬ЩҠ Щ„Щ„Ш°ШұШ© Ш№Щ„Щү 8 ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ЩғШӯШҜ ШЈЩӮШөЩү.
Ш§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ
ЩҠЩҸШ№ШұЩҒ Ш§Щ„Ш№ШҜШҜ Ш§Щ„ШҘШ¬Щ…Ш§Щ„ЩҠ Щ„Щ„ШЁШұЩҲШӘЩҲЩҶШ§ШӘ Ш§Щ„Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ ЩҶЩҲШ§Ш© Ш§Щ„Ш°ШұШ© ШЁШ§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ.
ЩҠШӯШҜШҜ Ш№ШҜШҜ ШЁШұЩҲШӘЩҲЩҶШ§ШӘ Ш§Щ„Ш°ШұШ© Ш§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ.
ЩҠШӘЩ… Ш§Щ„ШҘШҙШ§ШұШ© ШҘЩ„Щү Ш§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ ШЁШ§Щ„ШұЩ…ШІ "Z".
ШӘЩҸШ№ШұЩҒ ЩғЩ„Ш§ Ш§Щ„ШЁШұЩҲШӘЩҲЩҶШ§ШӘ ЩҲШ§Щ„ЩҶЩҠЩҲШӘШұЩҲЩҶШ§ШӘ ШЁШ§ШіЩ… ШЁШ§Щ„ЩҶЩҠЩҲЩғЩ„ЩҠЩҲЩҶШ§ШӘ.
Ш§Щ„Ш№ШҜШҜ Ш§Щ„ЩғШӘЩ„ЩҠ
ЩҠЩҸШ№ШұЩҒ Щ…Ш¬Щ…ЩҲШ№ Ш§Щ„Ш№ШҜШҜ Ш§Щ„ШҘШ¬Щ…Ш§Щ„ЩҠ Щ„Щ„ШЁШұЩҲШӘЩҲЩҶШ§ШӘ ЩҲШ§Щ„ЩҶЩҠЩҲШӘШұЩҲЩҶШ§ШӘ Ш§Щ„Щ…ЩҲШ¬ЩҲШҜШ© ЩҒЩҠ ЩҶЩҲШ§Ш© Ш§Щ„Ш°ШұШ© ШЁШ§Щ„ШұЩӮЩ… Ш§Щ„ЩғШӘЩ„ЩҠ.
Ш§Щ„ЩҶШёШ§ШҰШұ
ШӘЩҸШ№ШұЩҒ Ш°ШұШ§ШӘ Ш§Щ„Ш№ЩҶШөШұ ЩҶЩҒШіЩҮ ШҢ Ш§Щ„ШӘЩҠ Щ„ЩҮШ§ ЩҶЩҒШі Ш§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ ЩҲЩ„ЩғЩҶ ШЁШЈШ№ШҜШ§ШҜ ЩғШӘЩ„Ш© Щ…Ш®ШӘЩ„ЩҒШ© ШҢ ШЁШ§Щ„ЩҶШёШ§ШҰШұ. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„ ШӘШӯШӘЩҲЩҠ Ш°ШұШ© Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ Ш№Щ„Щү Ш«Щ„Ш§Ш«Ш© ЩҶШёШ§ШҰШұ ЩҲЩҮЩҠ Ш§Щ„ШЁШұЩҲШӘЩҠЩҲЩ… ЩҲШ§Щ„ШҜЩҠЩҲШӘЩҠШұЩҠЩҲЩ… ЩҲШ§Щ„ШӘШұЩҠШӘЩҠЩҲЩ….
ШӘШӘШҙШ§ШЁЩҮ Ш§Щ„Ш®ЩҲШ§Шө Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Щ„ЩҶШёШ§ШҰШұ Ш§Щ„Ш°ШұШ© Щ„ЩғЩҶ Ш®ЩҲШ§ШөЩҮШ§ Ш§Щ„ЩҒЩҠШІЩҠШ§ШҰЩҠШ© Щ…Ш®ШӘЩ„ЩҒШ©.
Ш§Щ„Ш§ЩҠШІЩҲШЁШ§ШұШ§ШӘ (Isobars)
ШӘЩҸШ№ШұЩҒ Ш°ШұШ§ШӘ Ш§Щ„Ш№ЩҶШ§ШөШұ Ш§Щ„Щ…Ш®ШӘЩ„ЩҒШ© Ш°Ш§ШӘ Ш§Щ„ШЈШ№ШҜШ§ШҜ Ш§Щ„Ш°ШұЩҠШ© Ш§Щ„Щ…Ш®ШӘЩ„ЩҒШ© ШҢ ЩҲШ§Щ„ШӘЩҠ Щ„ЩҮШ§ ЩҶЩҒШі Ш§Щ„Ш№ШҜШҜ Ш§Щ„ЩғШӘЩ„ЩҠ ШҢ ШЁШ§ШіЩ… Ш§Щ„ШЈЩҠШІЩҲШЁШ§Шұ. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„ Ш§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ Щ„Щ„ЩғШ§Щ„ШіЩҠЩҲЩ… ЩҮЩҲ 20 ЩҲШ§Щ„Ш№ШҜШҜ Ш§Щ„Ш°ШұЩҠ Щ„Щ„ШЈШұШ¬ЩҲЩҶ ЩҮЩҲ 18 Шӣ Ш№Щ„Ш§ЩҲШ© Ш№Щ„Щү Ш°Щ„Щғ ШҢ ЩҠШ®ШӘЩ„ЩҒ Ш№ШҜШҜ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ЩҒЩҠ ЩҮШ°ЩҮ Ш§Щ„Ш°ШұШ§ШӘ ШҢ Щ„ЩғЩҶ Ш§Щ„Ш№ШҜШҜ Ш§Щ„ЩғШӘЩ„ЩҠ Щ„ЩғЩ„Ш§ ЩҮШ°ЩҠЩҶ Ш§Щ„Ш№ЩҶШөШұЩҠЩҶ ЩҮЩҲ 40.
Щ„Ш§ ЩҠЩҲШ¬ШҜ ШӘШ№Щ„ЩҠЩӮШ§ШӘ
Щ„Ш§Ш¶Ш§ЩҒШ© ШіШӨШ§Щ„ Ш§ЩҲ ШӘШ№Щ„ЩҠЩӮ Ш№Щ„Щү Ш§Щ„ШҜШұШі ЩҠШӘЩҲШ¬ШЁ Ш№Щ„ЩҠЩғ ШӘШіШ¬ЩҠЩ„ Ш§Щ„ШҜШ®ЩҲЩ„
ШӘШіШ¬ЩҠЩ„ Ш§Щ„ШҜШ®ЩҲЩ„