في عام 500 قبل الميلاد ، افترض الفيلسوف الهندي مهاريشي كاناد لأول مرة مفهوم الجزء غير القابل للتجزئة من المادة وأطلق عليه اسم "برامانو".
في عام 1808 ، استخدم جون دالتون مصطلح "الذرة" وافترض النظرية الذرية لدراسة المادة.

نظرية دالتون الذرية
وفقًا لنظرية دالتون الذرية ، فإن كل مادة ، سواء كانت عنصرًا أو مركبًا أو مزيجاً ، تتكون من جسيمات صغيرة تسمى الذرات.
أهم ميزات نظرية دالتون الذرية
كل المواد مصنوعة من جسيمات صغيرة جدًا تُعرف بالذرات.
الذرة جسيم غير قابل للتجزئة ، ولا يمكن تكوينه أو تدميره عن طريق تفاعل كيميائي.
جميع ذرات العنصر متطابقة في الكتلة والخصائص الكيميائية بينما ذرات العناصر المختلفة لها كتل وخواص كيميائية مختلفة.
لتكوين مركب ، تتحد الذرات بنسبة أعداد صحيحة صغيرة.
في مركب معين ، يكون العدد النسبي للذرات وأنواعها ثابتًا.
الكتلة الذرية
كتلة الذرية لعنصر كيميائي ؛ يتم التعبير عنها بوحدات الكتلة الذرية (رمزها u).
تعادل الكتلة الذرية تقريبًا عدد البروتونات والنيوترونات الموجودة في الذرة.
وحدة الكتلة الذرية هي وحدة كتلة تساوي بالضبط (1/12) من كتلة ذرة كربون -12 وقد تم حساب الكتل الذرية النسبية لجميع العناصر بالنسبة إلى ذرة كربون -12.
الجزيء
أصغر جسيم لعنصر أو مركب قادر على الوجود بشكل مستقل وله جميع خصائص المادة المعنية.
عادةً ما يكون الجزيء عبارة عن مجموعة من ذرتين أو أكثر مترابطتين كيميائيًا معًا.
يمكن للذرات من نفس العنصر أو من عناصر مختلفة أن تتحد (مع رابطة كيميائية) معًا لتكوين جزيئات.
يُعرف عدد الذرات التي يتكون منها الجزيء باسم "عدد ذراته".
أيون
يُعرف الجسيم المشحون باسم الأيون ؛ يمكن أن يكون إما ذو شحنة سالبة أو ذو شحنة موجبة.
يُعرف الأيون ذو الشحنة الموجبة باسم "الكاتيون".
يُعرف الأيون ذو الشحنة السالبة باسم "الأنيون".
الصيغ الكيميائية
توضح الصيغة الكيميائية للمركب العناصر المكونة له وعدد الذرات كل العناصر في مركب.
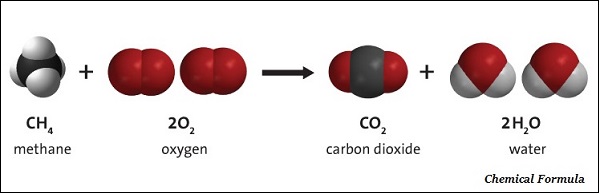
الصيغة الكيميائية للمركب هي تمثيل رمزي لتكوينه.
تُعرف قدرة العنصر على الاندماج باسم "التكافؤ".
الوزن الجزيئي
يتم حساب الوزن الجزيئي لمادة بأخذ مجموع الكتل الذرية لجميع الذرات في جزيء المادة المعنية. على سبيل المثال ، يتم حساب الوزن الجزيئي للماء على النحو التالي :
الكتلة الذرية للهيدروجين = 1 ش
الكتلة الذرية للأكسجين = 16 ش
يحتوي الماء على ذرتين من الهيدروجين وذرة واحدة من الأكسجين.
الوزن الجزيئي للماء =( 2 × 1)+ (1 × 16 ) = 18 u (u هي رمز الوزن الجزيئي).
كتلة وحدة الصيغة
تُحسب كتلة وحدة صيغة مادة بأخذ مجموع الكتل الذرية لجميع الذرات في وحدة صيغة للمركب.
ثابت أفوجادرو أو عدد أفوجادرو
كان أفوجادرو عالمًا إيطاليًا أعطى مفهوم رقم أفوجادرو (المعروف أيضًا باسم ثابت أفوجادرو).
إن عدد الجسيمات (الذرات ، الجزيئات ، أو الأيونات) الموجودة في 1 مول من أي مادة ثابت ، وقيمته 6.022 ₓ 1023.
في عام 1896 ، قدم ويليم أوستوالد مفهوم "المول" ؛ ومع ذلك ، تم قبول وحدة المول لتوفير طريقة بسيطة للتعبير عن عدد كبير في عام 1967.
قانون حفظ الكتلة
أثناء التفاعل الكيميائي ، يظل مجموع كتل المواد المتفاعلة والناتجة دون تغيير ، وهو ما يُعرف باسم "قانون حفظ الكتلة".
قانون النسب المحددة
في مركب كيميائي نقي ، تكون عناصره موجودة دائمًا بنسبة محددة بالكتلة ، والتي تُعرف باسم "قانون النسب المحددة".
لا يوجد تعليقات
لاضافة سؤال او تعليق على الدرس يتوجب عليك تسجيل الدخول
تسجيل الدخول