كل شيء موجود في هذا الكون يتكون من بعض المواد ، أطلق عليها العلماء اسم "المادة" matter. على سبيل المثال ، الطعام الذي نأكله ، الهواء الذي نتنفسه ، الحجارة ، الغيوم ، النجوم ، النباتات ، الحيوانات ، الماء ، الغبار ، كل شيء يصنف على أنه مادة.
خصائص جسيمات المادة
جسيمات المادة صغيرة جدًا ، فبعضاً منها لا يمكن رؤيتها بالعين المجردة.
تعتمد طاقة الجسيمات بشكل مباشر على درجة الحرارة , فكلما زادت درجة الحرارة سوف تزداد الطاقة الحركية أيضًا.
جسيمات المادة لها قوة جذب ؛ لذلك سوف تنجذب الجسيمات إلى بعضهم البعض.
تحافظ قوة جذب الجسيمات على تماسك الجسيمات ؛ ومع ذلك ، فإن شدة قوى الجذب سوف تختلف من نوع إلى آخر.
حالات المادة
للمادة ثلاث حالات وهي :
1. الحالة الصلبة
2. الحالة السائلة
3. الحالة الغازية
دعونا نناقشها بإيجاز
1. الحالة الصلبة
جميع المواد الصلبة لها شكل محدد ، وحدود مميزة ، وأحجام ثابتة.
معظم المواد الصلبة تمتلك قابلية اضغاط ضئيلة.
جميع المواد الصلبة تميل بشكل طبيعي للحفاظ على شكلها عندما تتعرض لقوة خارجية.
يمكننا تكسير المواد الصلبة بتطبيق عليها قوة ما ، ولكن من الصعب جدًا تغيير شكلها ، لأنها صلبة.
2. الحالة السائلة
على عكس المواد الصلبة ، فإن السوائل ليس لها شكل ثابت ؛ ومع ذلك ، لديهم حجم ثابت.
تأخذ السوائل شكل الوعاء الذي تحفظ فيها.
السوائل لها خواص التدفق وتغيير الشكل.
3. الحالة الغازية
تكون المادة على شكل هواء في هذه الحالة ، وهي ليست صلبة ولا سائلة ، فهي تُعرف كغاز. على سبيل المثال ، الأكسجين والنيتروجين والهيدروجين وما إلى ذلك.
على عكس المواد الصلبة ، فإن الغاز ليس له حجم وشكل محدد.
الغازات مثل غاز النفط المسال (LPG- المستخدم في الطهي) ؛ الغاز الطبيعي المضغوط (CNG - يستخدم كوقود للمركبات) ، وما إلى ذلك ، له قابلية عالية للانضغاط ؛ لذلك ، يمكن ضغط كمية كبيرة من الغاز في أسطوانة صغيرة ويمكن نقلها بسهولة.
تظهر الغازات ، بشكل طبيعي ، خاصية الانتشار السريع جدًا في الغازات الأخرى. هذا هو السبب في أننا يمكن أن نستنشقها (سواء كانت جيدة أو سيئة) من مسافة بعيدة.
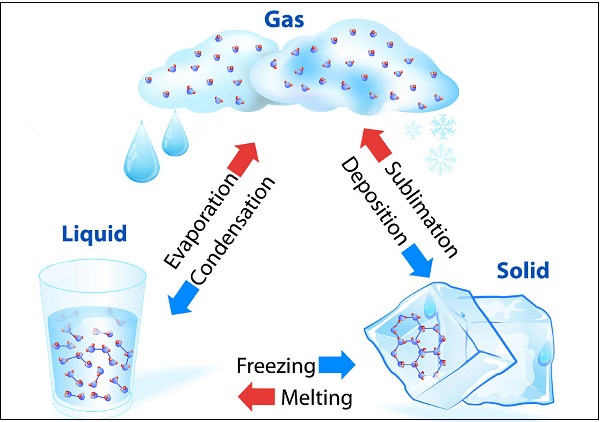
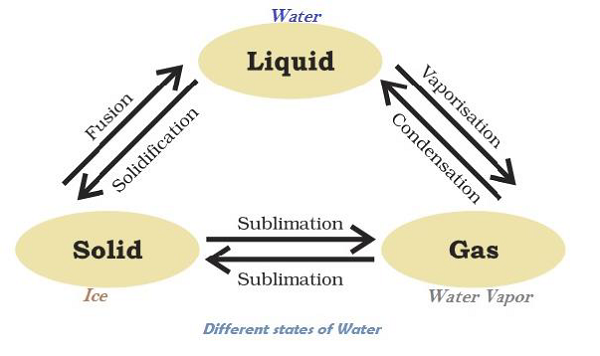
يمكن للمادة أن تغير حالتها:
يمكن أن توجد المياه في جميع الحالات الثلاث ، على سبيل المثال الجليد كمادة صلبة, الماء (H2O) كسائل ؛ وبخار الماء كغاز. يوضح الرسم البياني التالي تحول المياه في حالات مختلفة :
تُعرف درجة الحرارة التي تذوب فيها المادة الصلبة وتتحول إلى سائل (عند الضغط الجوي المعطى) ، باسم "نقطة الانصهار".
نقطة انصهار المادة الصلبة هي مؤشر على شدة قوى الجذب بين جزيئاتها.
تبلغ درجة انصهار الجليد 273.16 كلفن ، أي 0° درجة مئوية.
تُعرف عملية الذوبان (أي تغيير الحالة الصلبة إلى الحالة السائلة) بالانصهار.
تُعرف كمية الطاقة الحرارية المطلوبة لتحويل 1 كجم من مادة صلبة إلى مواد سائلة عند ضغط جوي معين ، باسم الحرارة الكامنة للانصهار.
تُعرف درجة الحرارة التي يبدأ عندها السائل بالغليان عند الضغط الجوي المحدد باسم "نقطة الغليان".
نقطة غليان الماء هي 373 كلفن أي 1000° درجة مئوية.
يُعرف تغيير حالة المادة مباشرة من الحالة الصلبة إلى الغازية دون التحول إلى الحالة السائلة (أو العكس) باسم "التصعيد".
تُعرف ظاهرة تغيير السائل إلى بخار عند أي درجة حرارة أقل من نقطة غليانه ، باسم "التبخر".
يتم تخزين ثاني أكسيد الكربون الصلب (CO2) تحت ضغط مرتفع.

يتم تحويل ثاني أكسيد الكربون الصلب مباشرة إلى حالة غازية بمجرد انخفاض الضغط إلى "1 جو".
الاتموسفير (atm) هو واحدة لقياس الضغط الغاز ، وواحدة الضغط هي باسكال (Pa) ؛ 1 جو = 1.01 × 105 باسكال.
الحالة الرابعة للمادة:
البلازما هي الحالة التي تتكون من جزيئات فائقة النشاط للغاية.

تم العثور على الجسيمات فائقة النشاط على شكل غازات مؤينة. على سبيل المثال يتكون أنبوب الفلورسنت (الذي يحتوي على غاز الهيليوم) ومصابيح النيون (التي تحتوي على غاز النيون) من البلازما.
لا يوجد تعليقات
لاضافة سؤال او تعليق على الدرس يتوجب عليك تسجيل الدخول
تسجيل الدخول