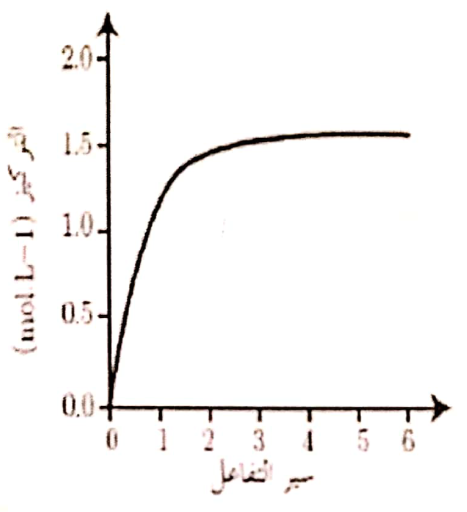
يتفاعل 1 مول من بخار اليود مع 1 مول من غاز الهيدروجين في وعار معلق حجمه 1L وفق المعادلة (H2 + I2 ↔2HI)
- كيمياء
- 2021-08-06
- HalaHamid
الأجوبة
C = n/V
[H2] = [I2] = 1/1 = 1 mol
H2 + I2 ↔ 2HI
1 1 0
1-x 1-x 2x
[HI] = 2x = 1.5 mol/L
X = 0.75 mol/L
[H2] = [I2] = 1-0.75 = 0.25 mol/L
Kc = [HI]2/([H2].[I2]) = [1.5]2/[0.25]2 = 36
أسئلة مشابهة
القوائم الدراسية التي ينتمي لها السؤال